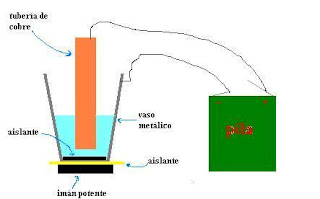
En esta experiencia vamos a construir un "motor líquido". Realmente se trata de un dispositivo en el que, aprovechando las propiedades del electromagnetismo y de las reacciones electroquímicas, podemos conseguir que un líquido comience a dar vueltas.
Qué necesitas
- 1 imán potente y grande (en la experiencia hemos utilizado el de un altavoz de graves)
- Vaso metálico (por ejemplo, de aluminio y de los que se usan para hacer flanes)
- Tubería de cobre. Sirve cualquier electrodo metálico o de grafito (por ejemplo, una mina de lápiz)
- 1 pila de 4,5 V o 9 V
- Cables para la conexión eléctrica
- Láminas de plástico o goma que sirvan de aislantes
- Disolución de sulfato de cobre (II). También se puede hacer con una disolución concentrada de sal común en agua.
Cómo lo hacemos
| El experimento funciona independientemente de la polaridad con la que se efectue la conexión. Sin embargo, es conveniente que el vaso vaya unido al polo "-" (negativo). De esta forma se deposita cobre sobre las paredes a la vez que se "disuelve" el electrodo central. Al contrario, se "disolvería" el aluminio del vaso y podría llegar a perforarse. |
La figura muestra cómo debe quedar montado el dispositivo para su correcto funcionamiento. En primer lugar, el vaso debe quedar apoyado sobre el imán, pero separado por una lámina aislante. Aunque no es del todo necesario y el dispositivo funcionaría sin el aislante, de esta forma evitamos que la corriente derive hacia el imán.
En el fondo del vaso colocamos otra lámina aislante. De esta forma conseguimos que los electrodos sean las paredes del vaso y la tubería de cobre.
Colocamos la disolución de forma que cubra parte de la tubería de cobre y conectamos el circuito. Cuando la corriente pasa, el líquido en el interior del vaso comienza a girar alrededor de la tubería de cobre. Ya tenemos el motor líquido.
¿Por qué ocurre esto?
Para comprender lo que ocurre tenemos que fijarnos en los dos fenómenos puestos en juego.
En primer lugar hay un proceso electroquímico. Al conectar la corriente eléctrica (continua) los electrodos atraen a los iones de la disolución hacia ellos. El electrodo positivo atrae a los iones negativos y el electrodo negativo a los iones positivos. El resultado global es que la disolución cierra el circuito y se establece una corriente eléctrica con el movimiento de los iones.
El movimiento de los iones tiene lugar en el seno de un campo magnético (el creado por el imán que tenemos debajo del vaso). Esto da lugar al segundo efecto que nos permite explicar el fenómeno. Se trata de un proceso electromagnético. Toda carga en movimiento en el seno de un campo magnético experimenta una fuerza de dirección perpendicular al vector velocidad y al vector campo magnético. Esto se presenta en algunos libros como la regla de la mano izquierda (Ley de Lorentz) y está en la base de cualquier motor eléctrico (en la figura, las X representan un campo magnético entrante y perpendicular al plano de la pantalla).
Pero lo más importante es que la fuerza es siempre perpendicular a la velocidad. Eso hace que se curve la trayectoria de las cargas y acaben dando vueltas en círculos alrededor de un punto, en este caso el electrodo central (la tubería de cobre). Las cargas no las podemos ver, pero sí el efecto de movimiento que tiene lugar en el líquido.
En los electrodos tienen lugar también procesos electroquímicos. En uno se produce una reacción de oxidación (de los iones) y en el otro una reducción. Si la disolución es de sulfato de cobre, veremos como en uno de los electrodos (en el negativo) los iones Cu2+ se transforman en Cu (metal) y se desprende un polvillo de color rojizo. Si se utilizan otras disoluciones, en los electrodos se desprenderán otras sustancias.